合一生技(4743)2022Q3 法說會整理

新藥股-合一生技(4743) 9/30 召開第三季法說會。
合一生技(4743)在Q3法說會上表示:「核酸新冠新藥(SNS812)預計2023年Q1完成一期臨床試驗,並在Q2進入二期臨床實驗。至於糖尿病足部傷口潰瘍新藥ON101的大陸藥證審查已進入最後關鍵期。」
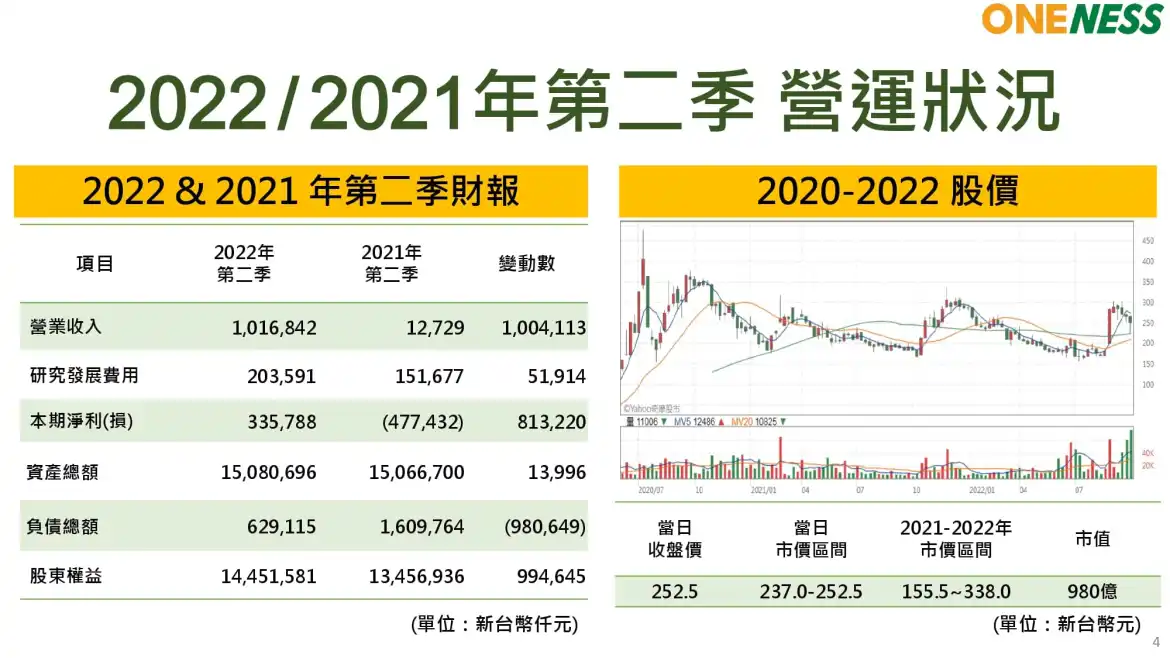
合一(4173)財報
合一(4743) Q2財報表現
- 2022年Q2營收為10.16億元,毛利為8.29億元,EPS為0.87元。
- 研發發展費用為2.03億,主要用於多項新藥國際臨床試驗,包括有三期、二期、一期、臨床前CMO及CRO費用等支出,2022年Q2占營業費用81%。
「營收成長主要受惠FB825中重度異味性皮膚炎美國lla臨床試驗報告於6月交付國際合作夥伴,簽約金3,360萬美金認列為營業收入。」

合一(4743)新藥研發進度及最新藥證進度
FB704A
- 嚴重氣喘_lla臨床試驗進度
2022年底二期臨床試驗加速收案
2023.H1完成收案
2023.H2完成試驗
市場潛力:目前已上市藥物仍無法有效控制疾病,為未被滿足的醫療需求,預估嚴重嗜中性球氣喘全球生物製劑治療市場可達美金數百億元。
- 第二適應症-改善慢性腎病(CKD)併發心血管疾病(CVD)
綜合動物與細胞實驗數據,FB704A有效抑制CKD關鍵指標,如肝球蛋白與嗜中性球等,具開發潛力。
2022.Q4 提出探索性臨床試驗申請
市場潛力:全球約7億人口罹患慢性腎病,其中約50%併發心血管疾病為致死主因,目前無有效治療預防策略,FB704A展現減少慢性腎病併發心血管疾病的治療潛力,將持續探索在全身性發炎相關疾病上的應用,增強產品價值。
ON101(速必一®)
- 美國FDA三期臨床試驗進度,視滾動式回覆意見進行修正。
市場潛力:異位性皮膚炎方面的市場潛力龐大,雖然合一(4743)沒有表示目標金額,讓我們以目前全球唯一上市的賽諾菲(Sanofi)杜必炎(Dupixent)為例,2019年(上市第三年)的銷售額就達20億美元,合一(4743)有望搶佔此市場。 後續規劃:合一(4743)已向美國FDA提出皮下注射/靜脈注射劑型人體PK橋接試驗,待確認PK橋接試驗數據後,再進一步進行2b/3期臨床試驗。中國大陸NDA(新藥查驗登記)申請進度,2022.08.26已完成發補意見回覆與技術性資料補件,後續進度將視主觀機關審查時程而定。
市場潛力:依據Fortune Business Insights的市場調查報告,糖尿病足潰瘍(DFU)的全球市場規模在2018年為66億美元,年複合成長率為6.8%,2026年市場預估約為110億美元。FB825
- 中重度異位性皮膚炎(AD)_美國試驗後續規劃
2022.09 已向美國FDA提出人體PK橋接試驗
2023.Q1 預定開始執行PK橋接試驗,同時完成藥物生產 - FB825-中重度過敏性氣喘(AA) _台灣lla臨床試驗進度
2022.Q4 台灣二期臨床試驗加速收案
2023.H1 完成收案
2024年 完成報告CSR
SNS812核酸新冠新藥(氣霧治療劑型)
正以美國IND(新藥臨床試驗) 許可,與中國藥監局協商,開啟中國新冠藥物的人體臨床試驗。
2022.09.14最新資料庫比對,SNS812對新冠變種株涵蓋率維持99.8%,競爭對手輝瑞小分子口服藥,在美國市占率達到90%,但2022.04及2022.08公布的臨床數據並不理想,未見顯著預防療效,目前合一(4743)已完成GLP毒埋試驗,未見明顯藥物相關毒性反應,並表示未來與國際大廠輝瑞的競爭優勢來自,SNS812因機制獨特,從源頭切斷並破壞病毒RNA,不易受病毒突變而影響療效。美國試驗進度
2022.09.23 已通過美國FDA 一期臨床試驗許可。
2023.Q1 完成一期臨床試驗。
2023.Q2 預定啟動臨床二期試驗。中國試驗進度
ON101(速必一®)_亞洲各國藥證申請進度
第一階段專案申請
A. 新加坡2022.08已完成新加坡HAS審查意見回覆。
B. 馬來西亞2022.08已完成馬來西亞NPRA審查意見回覆及樣品檢驗。
C. 泰國2022.09藥證申請合作夥伴簽約中,2022.Q4提交NDA申請。
第二階段專案
A. 印度2022.08 完成CDSCO提出補充資料。
B. 越南2022.07 受理NDA(審查時間20-28個月),尚未收到補件要求。
C. 菲律賓2022.04受理NDA(審查期限254天),尚未收到補件要求。
D. 印尼 2022.09 完成樣品送驗,2022.Q4 提交NDA行政審查。
第三階段專案
韓國 2022.10 提交申請臨床試驗減免。傷口外用乳膏_醫材進度
- 美國510(K)傷口外用乳膏醫材進度
2022.08.20 美國FDA認定及上市許可。
2023.Q1 取得出口許可後,可對外銷售。
其他優先考慮醫材准入申請,包括印度、南非、紐、澳。
- 歐洲疤痕護理醫材進度
2022.Q4申請歐盟MDR(醫療器材法規)。
2023.H1 完成新增傷口醫材品項。
2023.H2 提出傷口醫材申請。
合一(4743)未來營運展望
合一(4743)生技表示:「旗下傷口外用乳膏取得美國 FDA 510k 上市許可後,預計明年第一季拿到出口許可啟動對外銷售,另外去年底收到北美授權合約草約,不過考量 ON101 美國三期試驗仍在進行中,後續將待 FDA 審查資料後再進一步討論。」
合一法說會(4743)法人機構提問 Q&A
Q1:新冠病毒漸漸變為輕症,會影響SNS812之後的市場嗎?
Ans:「新冠病毒長期而言可能成為每年反覆發生的週期性流行病,SNS812為廣效型的小核酸新藥,治療效果不受病毒株突變影響,且具有顯著的預防效果,合一(4743)會加速臨床試驗與藥物開發進度。」
Q2:SNS812通過美國IND一期臨床許可,是否規劃在台灣提出,SNS812一期臨床試驗快速審查申請?
Ans:「合一(4743)評估,SNS812一期臨床試驗將在美國執行,後續二期試驗可採多中心方式執行,並視台灣疫情變化評估是否納入。」
Q3:鑽石生技(6901)已上興櫃,股價高低會反映在合一(4743)損益嗎?
Ans:「合一(4743)持有鑽石生技19.5%股權,擔任一席董事,採用權益法認列投資損益,按鑽石生技每月的損益,在損益表上認列投資損益,因此,鑽石生技股價的高低,不會反應在合一(4743)財務報表。」